Популярное
Полезные советы

Важно знать!
14 подходящих профессий для специалиста социально-экономического профиля
Приобретаемые навыки
Выпускник направления будет иметь компетенцию для решения следующих важных задач:
подготовка и проведение исследовательских кампаний: социологических, аналитических, консалтинговых;
подготовка...
Читать далее
20 лучших курсов по дистанционному обучению на психолога для начинающих и для повышения квалификации
9-й или 11-й? сколько школьных классов выгоднее заканчивать
10 популярных профессий для выпускников исторического факультета
30 лучших курсов по дизайну с нуля
20+ лучших творческих и развивающих онлайн-курсов для женщин
5-балльная или 10-балльная система оценок в школе
10 оптимальных мест работы для специалиста в электроэнергетике и электротехнике (обзор с уровнем зарплаты)
50 лучших цитат про учителей
6 вузов россии, где можно получить педагогическое образование дистанционно
Рекомендуем
Лучшее

Важно знать!
30 профессий, которые не требуют образования
Пять профессий, которые вы сможете освоить за полгода
В 2020 году пандемия коронавирусной инфекции сильно изменила международный рынок труда. Только в России 12 миллионов человек потеряли работу, а...
Читать далее
20 прибыльных профессий, которые высоко оплачиваются в сша и странах запада
6 бесплатных курсов по педагогике и онлайн-обучению
1 сентября
9 учебных заведений, в которых можно получить высшее сестринское образование заочно
10 лучших школ москвы, если не взяли в хогвартс
10 признаков того, что хороший программист из вас не получится
9 вещей, которые вы должны иметь в виду, прежде чем стать стоматологом
11 классов школы: какое это образование
5 вузов, где можно получить высшее образование онлайн
Обсуждаемое

Важно знать!
1c-разработчик
Должностные обязанности
Рассмотрим, что делает программист 1С на предприятии, в чем заключаются его обязанности. Прежде всего такому специалисту придется не только работать с программой 1С самому, но...
Читать далее
10 олимпиад, где может блеснуть знаниями школьник
10 игр для программистов, которые позволят улучшить свои навыки
7 способов получить дополнительные баллы при поступлении в 2020 году
30 популярных специальностей колледжей москвы 2021
5 ведущих вузов и колледжей россии, в которых можно получить педагогическое образование заочно
10 творческих профессий, связанных с литературой и русским языком
13 бесплатных онлайн-курсов по дизайну интерьера
5 самых наиболее популярных видов психологических тренингов
3 современных метода пересадки волос
Популярное
Актуальное

Важно знать!
7 профессий, связанных с едой: дегустатор, официант, технолог и другие
Испытатель видеоигр
Эта работа связана не только с удовольствием и развлечениями, как многие думают. Она требует от специалиста повышенного внимания, чтобы выискивать в играх ошибки и различные дефекты....
Читать далее
20 best 3d animation software in 2021 [free/paid]
8(914)8923: какой регион и оператор?
15 самых распространенных языков в мире
1 сентября личный кабинет
15 достойных вакансий для тех, кто не любит людей (16 фото)
Сервис менеджер ресторана
Курсы повышения квалификации для воспитателей доу: подборка и отзывы
Программист, экономист, инженер и ещё 7 профессий, где нужна математика
Гостевая книга
Обновления
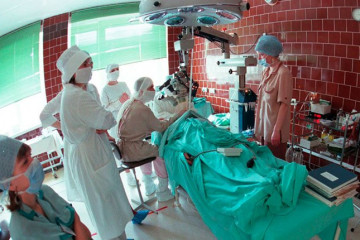 Аллоплант: чужой саженец вашего здоровья
Аллоплант: чужой саженец вашего здоровья
Технологии лечения
Для регенерации разных тканей создано более девяноста типов аллоплантов. Диспергированная...
 Обзор профессии видеомонтажер
Обзор профессии видеомонтажер
Оплата труда
Важные качества
Профессия режиссёра-постановщика предполагает артистизм, образное мышление,...
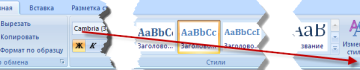 Как сделать оглавление в дипломной
Как сделать оглавление в дипломной
Как сделать оглавление (содержание) в Microsoft Word
Вы удивитесь, но в Word сделать это можно намного...
 Рейтинг лучших художественных вузов страны
Рейтинг лучших художественных вузов страны
ArtEZ University of the Arts, Нидерланды
ArtEZ - это художественная академия в списке лучших художественных...
 Топ-10 лучших гуманитарных профессий
Топ-10 лучших гуманитарных профессий
Недостатки профильных классов
Что касается минусов подобных программ обучения, то они следующие:
Отсутствие...
 Что должна содержать должностная инструкция секретаря: примеры и образцы документов
Что должна содержать должностная инструкция секретаря: примеры и образцы документов
Секретари в сфере образования
Если раньше вы считали эту работу едва ли не самой простой, достаточно...
 Направленности программ дополнительного образования детей
Направленности программ дополнительного образования детей
Виды ДПО
Designed by standret/Freepik
Дополнительное профессиональное образование обычно получают...
 Как выставляется оценка по математике в аттестат 9 класса?
Как выставляется оценка по математике в аттестат 9 класса?
Условия получения красного аттестата в 11 классе 2020 года
Красный аттестат после 11 класса — документ,...
 Аграрные вузы россии
Аграрные вузы россии
Список лучших вузов России, рейтинг 2021 года
Зато в регионах аграрные специальности и сельское хозяйство...
 Куда пойти учиться после 9 класса в г.мыски в 2021
Куда пойти учиться после 9 класса в г.мыски в 2021
Содержание
Заголовки для www.туэтт.рф
Веб-сервер
Информация о дата-центре
Время загрузки...
 Профессия недели: моряк. 11 фактов из жизни мореплавателей
Профессия недели: моряк. 11 фактов из жизни мореплавателей
Татуировка как оберег
Татуировка у моряков с давних времён считалась оберегом и опознавательным знаком....